▼講演会バックナンバー
2026-01-29
エネルギーの本質と、そのかたち
2026-01-28
冬の見えない殺し屋 ― 室内の二酸化炭素濃度 ―
2026-01-21
市民公開講座
2026-01-19
有機主食 ― 健康の土台は「食」にあり ―
2026-01-16
過去は変えられるのでしょうか
2026-01-15
新年初施療の楽しさ
2026-01-13
男女の健康意識の差
――中医学・生命哲学の視点から――
2026-01-12
再論「治病」と「治未病」
2026-01-11
中国医学は、過去と未来をつなぐ通路
2026-01-03
第4回 腫瘍統合治療学術研討会発表
2025-12-26
中国語による腫瘍統合治療 学術発表会のご案内
2025-12-24
中医学の先進性
2025-12-23
睡眠と免疫
2025-12-22
勉強になる学会
2025-12-21
腸内細菌に関する新たな知見
過去ブログはこちらから
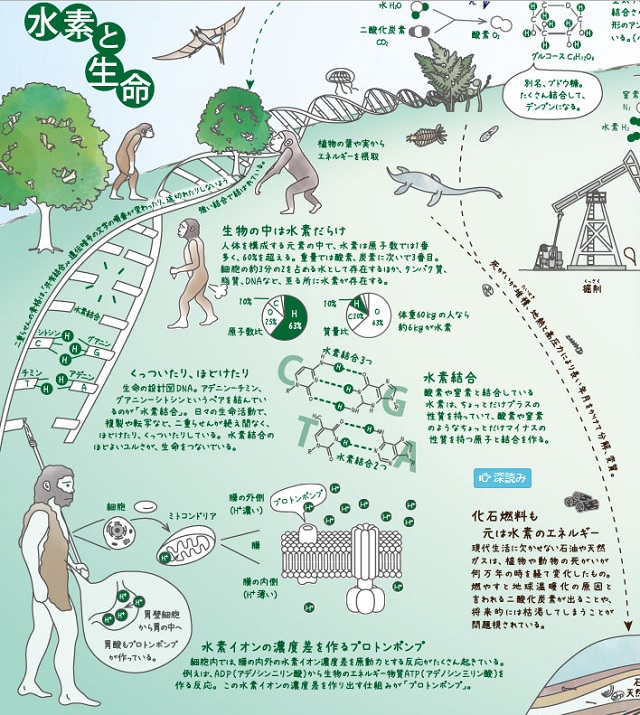
水素を勉強しよう③水素と生命
カテゴリー 講演会
生物の中は水素だらけでした。人体を構成する元素のなかで、水素は原子数では1番多く、60%を超えます。重量では酸素、炭素に次いで3番目です。細胞の約3分の2を占める水として存在するほか、タンパク質、脂質、DNAなど、至る所に水素が存在します。
水素結合
酸素や窒素と結合している水素はちょっとだけプラスの性質を持っていて、酸素や窒素のようなちょうとだけマイナスの性質を持つ原子と結合を作ります。
くっついたり、ほどけたり
生命の設計図DNAはアデニン(A)-チミン(T)、グアニン(G)-シトシン(C)というペアを結んでいるのが「水素結合」です。日々の生命活動で、複製や転写など、20らせんが絶え間なく、ほどけたり、くっついたりしています。水素結合のほどよいユルさが、生命を繋いでいます。
pHと水素
水素イオン(H+)
pHは、水溶液の水素イオンの濃度を表す指標。水溶液中の水素イオンの濃度は非常に小さな値であり、酸や塩基を加えた時の濃度の変化も大きいので、「水素イオンのモル濃度の逆数の常用対数」で表す方法が、1908年、デンマークの生化学者、セーレンセンによって提唱された。
現在、pHは、水素イオンのモル濃度ではなく、水素イオンの「活量」で定義されている。しかし、希薄溶液では活量と濃度は近い値を示すので、「水素イオン濃度」としても実質上問題ない。他にいろいろな物質が溶けている場合、水素イオンの活動が邪魔されるので、活量は濃度より小さい値になる。
水H2Oはほんのわずか解離して、水素イオンH+と水酸化物イオンOH-を生じている。水素イオン濃度 [H+]と水酸化物イオン濃度 [OH-]は等しく、25℃では1.0 × 10-7 mol/L。上の定義より、このときのpHは7となる。
[H+]と[OH-]の積を「水のイオン積」と呼び、温度一定であれば一定の値を示す。25℃では水のイオン積は 1 × 10-14 である。この値は、水に酸や塩基を加えても一定である。つまり、酸を加えてH+の量が10倍になれば、OH-の量は1/10になる。
水素イオン濃度 [H+]と水酸化物イオン濃度 [OH-]の濃度が等しい溶液を「中性」と呼ぶ。[H+]が大きければ酸性、[OH-]が大きければアルカリ性。25℃では中性はpH=7であり、このときの水素イオン濃度は1 × 10-7 [mol/L](0.0000001 mol/L)。酸性の溶液は水素イオン濃度が大きく、pH=3では [H+] = 1 × 10-3 [mol/L] (0.001 mol/L)。
水の解離は吸熱反応なので、温度を上げると解離が進む方向に平衡が移動する。したがって、温度が上がると水のイオン積は大きくなり、pHの値は小さくなる。50℃では、中性のpHは約6.5。反対に温度が下がるとpHは大きくなり、0℃では中性は約7.5。50℃と0℃ではpHが1違うので、水素イオンの濃度は50℃では0℃の10倍多いことになるが、どちらも「中性」(=[H+]と[OH-]が等しい)である。
文部科学省科学技術週間(一家に1枚)より
水素結合
酸素や窒素と結合している水素はちょっとだけプラスの性質を持っていて、酸素や窒素のようなちょうとだけマイナスの性質を持つ原子と結合を作ります。
くっついたり、ほどけたり
生命の設計図DNAはアデニン(A)-チミン(T)、グアニン(G)-シトシン(C)というペアを結んでいるのが「水素結合」です。日々の生命活動で、複製や転写など、20らせんが絶え間なく、ほどけたり、くっついたりしています。水素結合のほどよいユルさが、生命を繋いでいます。
pHと水素
水素イオン(H+)
pHは、水溶液の水素イオンの濃度を表す指標。水溶液中の水素イオンの濃度は非常に小さな値であり、酸や塩基を加えた時の濃度の変化も大きいので、「水素イオンのモル濃度の逆数の常用対数」で表す方法が、1908年、デンマークの生化学者、セーレンセンによって提唱された。
現在、pHは、水素イオンのモル濃度ではなく、水素イオンの「活量」で定義されている。しかし、希薄溶液では活量と濃度は近い値を示すので、「水素イオン濃度」としても実質上問題ない。他にいろいろな物質が溶けている場合、水素イオンの活動が邪魔されるので、活量は濃度より小さい値になる。
水H2Oはほんのわずか解離して、水素イオンH+と水酸化物イオンOH-を生じている。水素イオン濃度 [H+]と水酸化物イオン濃度 [OH-]は等しく、25℃では1.0 × 10-7 mol/L。上の定義より、このときのpHは7となる。
[H+]と[OH-]の積を「水のイオン積」と呼び、温度一定であれば一定の値を示す。25℃では水のイオン積は 1 × 10-14 である。この値は、水に酸や塩基を加えても一定である。つまり、酸を加えてH+の量が10倍になれば、OH-の量は1/10になる。
水素イオン濃度 [H+]と水酸化物イオン濃度 [OH-]の濃度が等しい溶液を「中性」と呼ぶ。[H+]が大きければ酸性、[OH-]が大きければアルカリ性。25℃では中性はpH=7であり、このときの水素イオン濃度は1 × 10-7 [mol/L](0.0000001 mol/L)。酸性の溶液は水素イオン濃度が大きく、pH=3では [H+] = 1 × 10-3 [mol/L] (0.001 mol/L)。
水の解離は吸熱反応なので、温度を上げると解離が進む方向に平衡が移動する。したがって、温度が上がると水のイオン積は大きくなり、pHの値は小さくなる。50℃では、中性のpHは約6.5。反対に温度が下がるとpHは大きくなり、0℃では中性は約7.5。50℃と0℃ではpHが1違うので、水素イオンの濃度は50℃では0℃の10倍多いことになるが、どちらも「中性」(=[H+]と[OH-]が等しい)である。
文部科学省科学技術週間(一家に1枚)より
2019-03-24




