2026-01-11
吃透 2026 五运六气(丙午马年):精准推演全解析 + 对症调理方案
2026-01-06
第四届肿瘤统合治疗学术研讨会在东京大学圆满落幕
2026-01-04
《从〈黄帝内经〉看中医治疗肿瘤理念的先进性》
2025-12-12
东瀛万事通・今日头条・中文導報・日本东方新报:北海道中国会举办第十二届总会&恳亲忘年会
2025-11-06
2025年北海道华侨华人春节联欢会盛大举行
2025-08-25
2025年“札幌中国节”成功举行 彩绘水墨画惊艳北海道 美声颂歌回响红砖广场
2025-07-31
陶永芳:我是世上最幸福的老人
2025-07-30
陶永芳:回想在日本住院的那些日子
2025-07-16
第2届全日本华侨华人业余高尔夫锦标赛&第11届北海道中国会杯高尔夫大会成功举行
2025-07-02
第60届中国人殉难者全道慰灵祭在北海道仁木町民中心举行
2024-12-16
肿瘤整合治疗联盟:第二届肿瘤整合治疗学术研讨会成功举办
2025-06-14
汗,是脾胃的镜子
2025-05-22
教你如何区分阴虚和阳虚,一学就会!
2025-02-24
艾灸最怕这一个字!90%的人做错,这样灸比吃补品更有效
2025-02-23
这些常见中药搭配,用对效果加倍
2025-02-02
中医和西医在治病原则区别
2025-02-01
李可老中医的一句话,拯救了无数肿瘤患者!
2025-01-26
仝小林院士:体病药论与治未病
2025-01-11
从五运六气看六经辨证
2023-12-06
黄帝内经治未病陶氏疗法在日本临床应用25年研讨⑪
2024-12-09
放几滴血,口腔溃疡就会痊愈,不信你试试!
2024-12-03
三魂七魄,看看哪个已不在您身上?
2024-12-02
中文导报 东瀛万事通 今日头条:北海道中国会举办第十一届总会&恳亲会
2024-11-09
艾烟,到底有没有害?
2024-10-13
经络不通,补什么都没用!只用一招:经络通畅百病消!
2024-10-08
你每天这样吸收大量阴气,怎么可能不生病?
2024-10-05
中医觉醒,认识经方——读懂《伤寒论》
2024-09-23
奥运体操全能王冈慎之助助阵:DENBA Moblie新品东京发表
2024-09-21
这样刮刮痧,活到八十八
2024-09-17
王振义被授予“共和国勋章”!他曾说:用循证研究证明中医药是个“宝”
3
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
重磅!Jeffrey C. Hall,Michael Rosbash和Michael W. Young三人斩获2017年诺贝尔生理学与医学奖!本文将详细解读下!
“For the greatest to mankind” – 阿尔弗雷德·诺贝尔
每年的诺贝尔奖是学术界最大的盛世之一,今年斩获诺贝尔生理学医学奖的是三位科学家,Jeffrey C. Hall,Michael Rosbash和Michael W. Young,以表彰他们在生物节律方面的杰出贡献。
参与这项重要研究的三位科学家均来自美国。
Jeffrey C. Hall 于1945年出生于美国的纽约市,并在1971年获得华盛顿大学(University of Washington in Seattle)的博士学位,并在加州理工大学(California Institute of Technology)从事博士后的工作。Hall在1974年任教于布兰迪斯大学(Brandeis University in Waltham)。在2002年,他成为了缅因大学(University of Maine)的副教授。
Michael Rosbash于1944年生于美国的堪萨斯市,在1970年获得麻省理工大学(Massachusetts Institute of Technology in Cambridge)的博士学位。随后三年,Rosbash在爱丁堡大学(University of Edingburgh)从事博士后的相关工作。从1974年来,他一致任职于布兰迪斯大学(Brandeis University in Waltham)。
Michael W. Young于1949年生于美国的迈阿密,他于1975年获得德克萨斯大学奥斯汀分校(University of Texas at Austin)的博士学位。1975年到1977年,他在斯坦福大学(Stanford University)从事博士后的工作。从1978年以来,Young任职于洛克菲勒大学(Rockefeller University in New York)。
详解生物节律现象
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
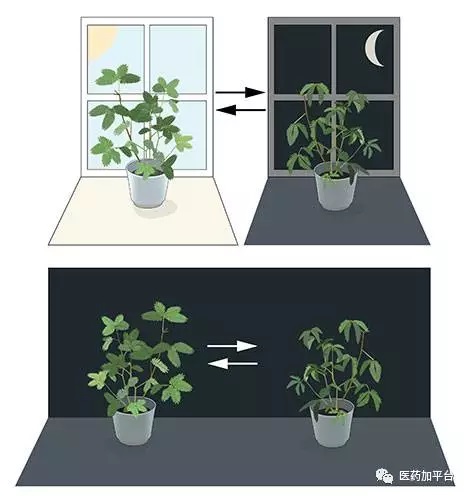
(图一:生物节律的一个现象。含羞草的叶片白天展开,朝向太阳,但在夜间关闭)
数万年来,地球上的生物已经适应了我们这颗星球的周而复始的运动。人们的每日起居,植物的向阳活动,动物的季节性活动,无不由生物体内的一个内在的“钟”在控制着。我们平时所说的“生物钟”就是生物节律现象的一种简单表述。 我们无比熟悉的生物节律现象——这一个精密的“生物钟”,究竟是怎么运作的呢?Jeffrey C. Hall,Michael Rosbash和Michael W. Young三位科学家通过他们的研究解开了这个谜团,从分子机制上解释了生物节律。他们的发现意义重大,解释了植物,动物和人类是如何调节自身生物节律以适应地球的进化。
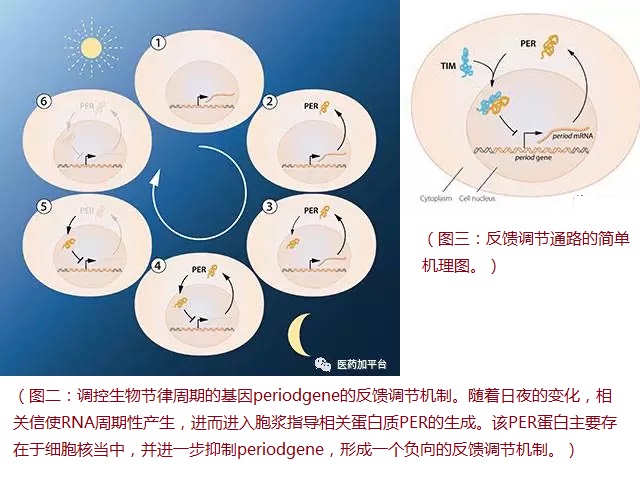
通过利用果蝇作为生物模型,今年的诺贝尔生理学与医学奖得主们分离到了一种能够调控正常每日生物节律的基因——periodgene。他们发现该基因编码一种在夜间积累,而在日间分解的蛋白PER,进而他们又发现另一种参与生物节律机制的蛋白组分TIM,从分子层面上揭示了其机理。
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
(图二:调控生物节律周期的基因periodgene的反馈调节机制。随着日夜的变化,相关信使RNA周期性产生,进而进入胞浆指导相关蛋白质PER的生成。该PER蛋白主要存在于细胞核当中,并进一步抑制periodgene,形成一个负向的反馈调节机制。)
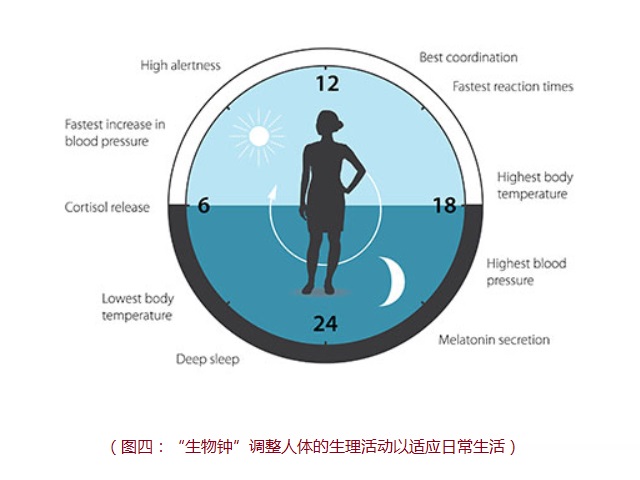
我们细胞内的“生物钟”具有非常高的精准度,能够调节我们的不同生理活动以适应于环境的各种不同的变化。这种“生物钟”调控着一些非常重要的功能,例如行为,激素水平,睡眠,体温和代谢。一旦外界的环境和我们内在的生物钟不匹配,微小的差池便会影响到人体的健康,“倒时差”这样一种现象就是一个最好的例子。长期的“生物钟”紊乱会进一步造成更严重的后果,增加一系列疾病的风险。
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
对于生物节律的研究,不仅仅是揭示了一种生理现象,更是提供给了人们降低一些疾病风险,提高生活质量的机会,同时也能够更广泛的了解自然,了解存在于所有生物当中的广泛的哲学。
【注】
部分内容译自https://www.nobelprize.org/nobel_prizes/medicine/laureates/2017/press.html
【重要参考文献】
Zehring, W.A., Wheeler, D.A., Reddy, P., Konopka, R.J., Kyriacou, C.P., Rosbash, M., and Hall, J.C. (1984). P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell 39, 369–376.
Bargiello, T.A., Jackson, F.R., and Young, M.W. (1984). Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature 312, 752–754.
Siwicki, K.K., Eastman, C., Petersen, G., Rosbash, M., and Hall, J.C. (1988). Antibodies to the period gene product of Drosophila reveal diverse tissue distribution and rhythmic changes in the visual system. Neuron 1, 141–150.
Hardin, P.E., Hall, J.C., and Rosbash, M. (1990). Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels. Nature 343, 536–540.
Liu, X., Zwiebel, L.J., Hinton, D., Benzer, S., Hall, J.C., and Rosbash, M. (1992). The period gene encodes a predominantly nuclear protein in adult Drosophila. J Neurosci 12, 2735–2744.
Vosshall, L.B., Price, J.L., Sehgal, A., Saez, L., and Young, M.W. (1994). Block in nuclear localization of period protein by a second clock mutation, timeless. Science 263, 1606–1609.
Price, J.L., Blau, J., Rothenfluh, A., Abodeely, M., Kloss, B., and Young, M.W. (1998). double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation. Cell 94, 83–95.
“For the greatest to mankind” – 阿尔弗雷德·诺贝尔
每年的诺贝尔奖是学术界最大的盛世之一,今年斩获诺贝尔生理学医学奖的是三位科学家,Jeffrey C. Hall,Michael Rosbash和Michael W. Young,以表彰他们在生物节律方面的杰出贡献。
参与这项重要研究的三位科学家均来自美国。
Jeffrey C. Hall 于1945年出生于美国的纽约市,并在1971年获得华盛顿大学(University of Washington in Seattle)的博士学位,并在加州理工大学(California Institute of Technology)从事博士后的工作。Hall在1974年任教于布兰迪斯大学(Brandeis University in Waltham)。在2002年,他成为了缅因大学(University of Maine)的副教授。
Michael Rosbash于1944年生于美国的堪萨斯市,在1970年获得麻省理工大学(Massachusetts Institute of Technology in Cambridge)的博士学位。随后三年,Rosbash在爱丁堡大学(University of Edingburgh)从事博士后的相关工作。从1974年来,他一致任职于布兰迪斯大学(Brandeis University in Waltham)。
Michael W. Young于1949年生于美国的迈阿密,他于1975年获得德克萨斯大学奥斯汀分校(University of Texas at Austin)的博士学位。1975年到1977年,他在斯坦福大学(Stanford University)从事博士后的工作。从1978年以来,Young任职于洛克菲勒大学(Rockefeller University in New York)。
详解生物节律现象
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
(图一:生物节律的一个现象。含羞草的叶片白天展开,朝向太阳,但在夜间关闭)
数万年来,地球上的生物已经适应了我们这颗星球的周而复始的运动。人们的每日起居,植物的向阳活动,动物的季节性活动,无不由生物体内的一个内在的“钟”在控制着。我们平时所说的“生物钟”就是生物节律现象的一种简单表述。 我们无比熟悉的生物节律现象——这一个精密的“生物钟”,究竟是怎么运作的呢?Jeffrey C. Hall,Michael Rosbash和Michael W. Young三位科学家通过他们的研究解开了这个谜团,从分子机制上解释了生物节律。他们的发现意义重大,解释了植物,动物和人类是如何调节自身生物节律以适应地球的进化。
通过利用果蝇作为生物模型,今年的诺贝尔生理学与医学奖得主们分离到了一种能够调控正常每日生物节律的基因——periodgene。他们发现该基因编码一种在夜间积累,而在日间分解的蛋白PER,进而他们又发现另一种参与生物节律机制的蛋白组分TIM,从分子层面上揭示了其机理。
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
(图二:调控生物节律周期的基因periodgene的反馈调节机制。随着日夜的变化,相关信使RNA周期性产生,进而进入胞浆指导相关蛋白质PER的生成。该PER蛋白主要存在于细胞核当中,并进一步抑制periodgene,形成一个负向的反馈调节机制。)
我们细胞内的“生物钟”具有非常高的精准度,能够调节我们的不同生理活动以适应于环境的各种不同的变化。这种“生物钟”调控着一些非常重要的功能,例如行为,激素水平,睡眠,体温和代谢。一旦外界的环境和我们内在的生物钟不匹配,微小的差池便会影响到人体的健康,“倒时差”这样一种现象就是一个最好的例子。长期的“生物钟”紊乱会进一步造成更严重的后果,增加一系列疾病的风险。
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
对于生物节律的研究,不仅仅是揭示了一种生理现象,更是提供给了人们降低一些疾病风险,提高生活质量的机会,同时也能够更广泛的了解自然,了解存在于所有生物当中的广泛的哲学。
【注】
部分内容译自https://www.nobelprize.org/nobel_prizes/medicine/laureates/2017/press.html
【重要参考文献】
Zehring, W.A., Wheeler, D.A., Reddy, P., Konopka, R.J., Kyriacou, C.P., Rosbash, M., and Hall, J.C. (1984). P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell 39, 369–376.
Bargiello, T.A., Jackson, F.R., and Young, M.W. (1984). Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature 312, 752–754.
Siwicki, K.K., Eastman, C., Petersen, G., Rosbash, M., and Hall, J.C. (1988). Antibodies to the period gene product of Drosophila reveal diverse tissue distribution and rhythmic changes in the visual system. Neuron 1, 141–150.
Hardin, P.E., Hall, J.C., and Rosbash, M. (1990). Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels. Nature 343, 536–540.
Liu, X., Zwiebel, L.J., Hinton, D., Benzer, S., Hall, J.C., and Rosbash, M. (1992). The period gene encodes a predominantly nuclear protein in adult Drosophila. J Neurosci 12, 2735–2744.
Vosshall, L.B., Price, J.L., Sehgal, A., Saez, L., and Young, M.W. (1994). Block in nuclear localization of period protein by a second clock mutation, timeless. Science 263, 1606–1609.
Price, J.L., Blau, J., Rothenfluh, A., Abodeely, M., Kloss, B., and Young, M.W. (1998). double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation. Cell 94, 83–95.