2024-04-23
“筋长一寸、寿延十年”,原来这才是正确的拉筋方法!但4类人不适合
2024-04-18
心累吃红豆,脑累吃核桃,眼累吃?这六种抗疲劳的食物,快收好!
2024-03-30
睡不好,百病生,国医大师支招,让你睡个安稳觉!
2023-11-03
午睡可能影响寿命!再次提醒:55岁以后,牢记午睡“三不要
2023-03-15
梨易伤脾胃,最伤肾的水果原来是它!你该吃啥水果,一文说清楚!
2022-11-24
“被子重,睡得香”有科学依据了!盖厚被子4周,失眠降一半~不过,盖被子也有这些讲究
2022-11-23
上海科学家最新研究!中国900多万糖尿病例源于人造光
2022-11-10
一个超级补肾的动作,小孩子天生就会,大人却忘了,练习后你才知道它有多强大!
2022-08-03
三伏天洗澡,尽量绕开3个时间段,否则湿气会“悄然到来”
2022-07-28
小六壬预测法知识总结,简单易学
2022-07-21
四大血型寿命排行榜公布:b型血仅排第二,第一名令人意外...
2022-07-07
食物升血糖排行榜,4 张图教你放心吃
2022-06-20
比白糖和酒精更可怕的健康杀手,竟然是它!我们几乎天天在吃!
2022-06-19
仁 者 長 壽
2022-06-07
俗语:“不想短 命,莫睡三觉”,指的是哪“三觉”?
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
博客分类 生活中的医学智慧
重磅!Jeffrey C. Hall,Michael Rosbash和Michael W. Young三人斩获2017年诺贝尔生理学与医学奖!本文将详细解读下!
“For the greatest to mankind” – 阿尔弗雷德·诺贝尔
每年的诺贝尔奖是学术界最大的盛世之一,今年斩获诺贝尔生理学医学奖的是三位科学家,Jeffrey C. Hall,Michael Rosbash和Michael W. Young,以表彰他们在生物节律方面的杰出贡献。
参与这项重要研究的三位科学家均来自美国。
Jeffrey C. Hall 于1945年出生于美国的纽约市,并在1971年获得华盛顿大学(University of Washington in Seattle)的博士学位,并在加州理工大学(California Institute of Technology)从事博士后的工作。Hall在1974年任教于布兰迪斯大学(Brandeis University in Waltham)。在2002年,他成为了缅因大学(University of Maine)的副教授。
Michael Rosbash于1944年生于美国的堪萨斯市,在1970年获得麻省理工大学(Massachusetts Institute of Technology in Cambridge)的博士学位。随后三年,Rosbash在爱丁堡大学(University of Edingburgh)从事博士后的相关工作。从1974年来,他一致任职于布兰迪斯大学(Brandeis University in Waltham)。
Michael W. Young于1949年生于美国的迈阿密,他于1975年获得德克萨斯大学奥斯汀分校(University of Texas at Austin)的博士学位。1975年到1977年,他在斯坦福大学(Stanford University)从事博士后的工作。从1978年以来,Young任职于洛克菲勒大学(Rockefeller University in New York)。
详解生物节律现象
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
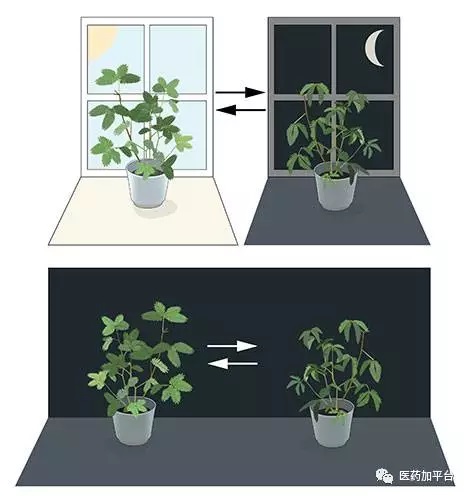
(图一:生物节律的一个现象。含羞草的叶片白天展开,朝向太阳,但在夜间关闭)
数万年来,地球上的生物已经适应了我们这颗星球的周而复始的运动。人们的每日起居,植物的向阳活动,动物的季节性活动,无不由生物体内的一个内在的“钟”在控制着。我们平时所说的“生物钟”就是生物节律现象的一种简单表述。 我们无比熟悉的生物节律现象——这一个精密的“生物钟”,究竟是怎么运作的呢?Jeffrey C. Hall,Michael Rosbash和Michael W. Young三位科学家通过他们的研究解开了这个谜团,从分子机制上解释了生物节律。他们的发现意义重大,解释了植物,动物和人类是如何调节自身生物节律以适应地球的进化。
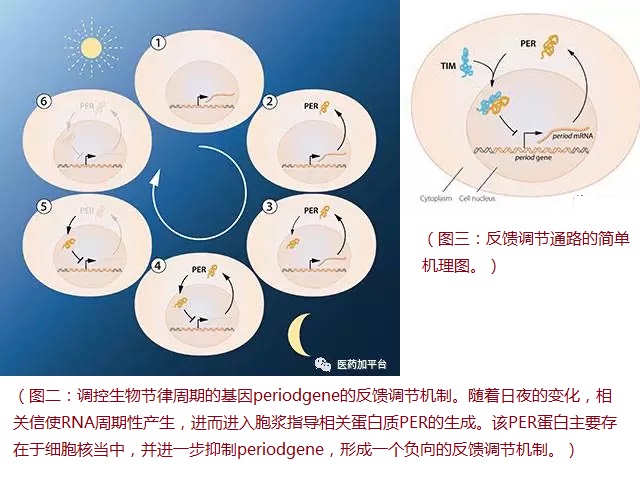
通过利用果蝇作为生物模型,今年的诺贝尔生理学与医学奖得主们分离到了一种能够调控正常每日生物节律的基因——periodgene。他们发现该基因编码一种在夜间积累,而在日间分解的蛋白PER,进而他们又发现另一种参与生物节律机制的蛋白组分TIM,从分子层面上揭示了其机理。
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
(图二:调控生物节律周期的基因periodgene的反馈调节机制。随着日夜的变化,相关信使RNA周期性产生,进而进入胞浆指导相关蛋白质PER的生成。该PER蛋白主要存在于细胞核当中,并进一步抑制periodgene,形成一个负向的反馈调节机制。)
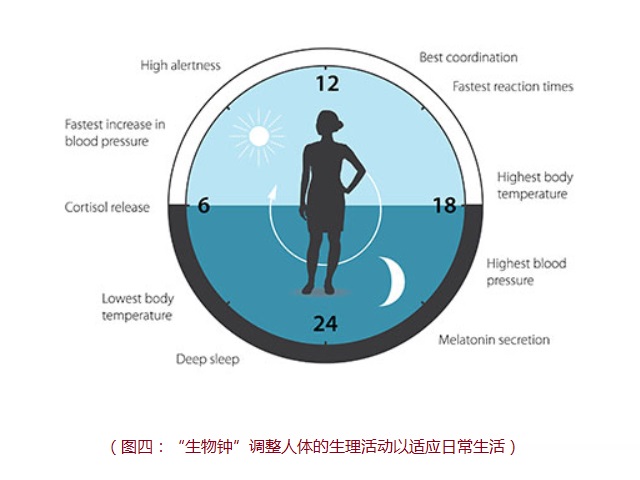
我们细胞内的“生物钟”具有非常高的精准度,能够调节我们的不同生理活动以适应于环境的各种不同的变化。这种“生物钟”调控着一些非常重要的功能,例如行为,激素水平,睡眠,体温和代谢。一旦外界的环境和我们内在的生物钟不匹配,微小的差池便会影响到人体的健康,“倒时差”这样一种现象就是一个最好的例子。长期的“生物钟”紊乱会进一步造成更严重的后果,增加一系列疾病的风险。
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
对于生物节律的研究,不仅仅是揭示了一种生理现象,更是提供给了人们降低一些疾病风险,提高生活质量的机会,同时也能够更广泛的了解自然,了解存在于所有生物当中的广泛的哲学。
【注】
部分内容译自https://www.nobelprize.org/nobel_prizes/medicine/laureates/2017/press.html
【重要参考文献】
Zehring, W.A., Wheeler, D.A., Reddy, P., Konopka, R.J., Kyriacou, C.P., Rosbash, M., and Hall, J.C. (1984). P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell 39, 369–376.
Bargiello, T.A., Jackson, F.R., and Young, M.W. (1984). Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature 312, 752–754.
Siwicki, K.K., Eastman, C., Petersen, G., Rosbash, M., and Hall, J.C. (1988). Antibodies to the period gene product of Drosophila reveal diverse tissue distribution and rhythmic changes in the visual system. Neuron 1, 141–150.
Hardin, P.E., Hall, J.C., and Rosbash, M. (1990). Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels. Nature 343, 536–540.
Liu, X., Zwiebel, L.J., Hinton, D., Benzer, S., Hall, J.C., and Rosbash, M. (1992). The period gene encodes a predominantly nuclear protein in adult Drosophila. J Neurosci 12, 2735–2744.
Vosshall, L.B., Price, J.L., Sehgal, A., Saez, L., and Young, M.W. (1994). Block in nuclear localization of period protein by a second clock mutation, timeless. Science 263, 1606–1609.
Price, J.L., Blau, J., Rothenfluh, A., Abodeely, M., Kloss, B., and Young, M.W. (1998). double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation. Cell 94, 83–95.
“For the greatest to mankind” – 阿尔弗雷德·诺贝尔
每年的诺贝尔奖是学术界最大的盛世之一,今年斩获诺贝尔生理学医学奖的是三位科学家,Jeffrey C. Hall,Michael Rosbash和Michael W. Young,以表彰他们在生物节律方面的杰出贡献。
参与这项重要研究的三位科学家均来自美国。
Jeffrey C. Hall 于1945年出生于美国的纽约市,并在1971年获得华盛顿大学(University of Washington in Seattle)的博士学位,并在加州理工大学(California Institute of Technology)从事博士后的工作。Hall在1974年任教于布兰迪斯大学(Brandeis University in Waltham)。在2002年,他成为了缅因大学(University of Maine)的副教授。
Michael Rosbash于1944年生于美国的堪萨斯市,在1970年获得麻省理工大学(Massachusetts Institute of Technology in Cambridge)的博士学位。随后三年,Rosbash在爱丁堡大学(University of Edingburgh)从事博士后的相关工作。从1974年来,他一致任职于布兰迪斯大学(Brandeis University in Waltham)。
Michael W. Young于1949年生于美国的迈阿密,他于1975年获得德克萨斯大学奥斯汀分校(University of Texas at Austin)的博士学位。1975年到1977年,他在斯坦福大学(Stanford University)从事博士后的工作。从1978年以来,Young任职于洛克菲勒大学(Rockefeller University in New York)。
详解生物节律现象
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
(图一:生物节律的一个现象。含羞草的叶片白天展开,朝向太阳,但在夜间关闭)
数万年来,地球上的生物已经适应了我们这颗星球的周而复始的运动。人们的每日起居,植物的向阳活动,动物的季节性活动,无不由生物体内的一个内在的“钟”在控制着。我们平时所说的“生物钟”就是生物节律现象的一种简单表述。 我们无比熟悉的生物节律现象——这一个精密的“生物钟”,究竟是怎么运作的呢?Jeffrey C. Hall,Michael Rosbash和Michael W. Young三位科学家通过他们的研究解开了这个谜团,从分子机制上解释了生物节律。他们的发现意义重大,解释了植物,动物和人类是如何调节自身生物节律以适应地球的进化。
通过利用果蝇作为生物模型,今年的诺贝尔生理学与医学奖得主们分离到了一种能够调控正常每日生物节律的基因——periodgene。他们发现该基因编码一种在夜间积累,而在日间分解的蛋白PER,进而他们又发现另一种参与生物节律机制的蛋白组分TIM,从分子层面上揭示了其机理。
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
(图二:调控生物节律周期的基因periodgene的反馈调节机制。随着日夜的变化,相关信使RNA周期性产生,进而进入胞浆指导相关蛋白质PER的生成。该PER蛋白主要存在于细胞核当中,并进一步抑制periodgene,形成一个负向的反馈调节机制。)
我们细胞内的“生物钟”具有非常高的精准度,能够调节我们的不同生理活动以适应于环境的各种不同的变化。这种“生物钟”调控着一些非常重要的功能,例如行为,激素水平,睡眠,体温和代谢。一旦外界的环境和我们内在的生物钟不匹配,微小的差池便会影响到人体的健康,“倒时差”这样一种现象就是一个最好的例子。长期的“生物钟”紊乱会进一步造成更严重的后果,增加一系列疾病的风险。
重磅!研究生物节律方面的三人科学家斩获2017年诺贝尔生理学与医学奖!
对于生物节律的研究,不仅仅是揭示了一种生理现象,更是提供给了人们降低一些疾病风险,提高生活质量的机会,同时也能够更广泛的了解自然,了解存在于所有生物当中的广泛的哲学。
【注】
部分内容译自https://www.nobelprize.org/nobel_prizes/medicine/laureates/2017/press.html
【重要参考文献】
Zehring, W.A., Wheeler, D.A., Reddy, P., Konopka, R.J., Kyriacou, C.P., Rosbash, M., and Hall, J.C. (1984). P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell 39, 369–376.
Bargiello, T.A., Jackson, F.R., and Young, M.W. (1984). Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature 312, 752–754.
Siwicki, K.K., Eastman, C., Petersen, G., Rosbash, M., and Hall, J.C. (1988). Antibodies to the period gene product of Drosophila reveal diverse tissue distribution and rhythmic changes in the visual system. Neuron 1, 141–150.
Hardin, P.E., Hall, J.C., and Rosbash, M. (1990). Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels. Nature 343, 536–540.
Liu, X., Zwiebel, L.J., Hinton, D., Benzer, S., Hall, J.C., and Rosbash, M. (1992). The period gene encodes a predominantly nuclear protein in adult Drosophila. J Neurosci 12, 2735–2744.
Vosshall, L.B., Price, J.L., Sehgal, A., Saez, L., and Young, M.W. (1994). Block in nuclear localization of period protein by a second clock mutation, timeless. Science 263, 1606–1609.
Price, J.L., Blau, J., Rothenfluh, A., Abodeely, M., Kloss, B., and Young, M.W. (1998). double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation. Cell 94, 83–95.

2017-10-03







